上海琥珀報關代理(lǐ),上海琥珀報關公(gōng)司
品名(míng):琥珀 原産(chǎn)國(guó):墨西哥(gē)
琥珀原石進口疑難問題
操作(zuò)難點:海關審價嚴格,發貨時未準确稱重、同時增加了通關難度。我司操作(zuò)部耐心配合、專業指導最終高效地保證了琥珀順利通關。
因琥珀屬于半寶石,為(wèi)了節省審價時間,最好能(néng)提供價格依據,如付彙證明,購(gòu)買協議等。
報關單展示:

稅單展示:
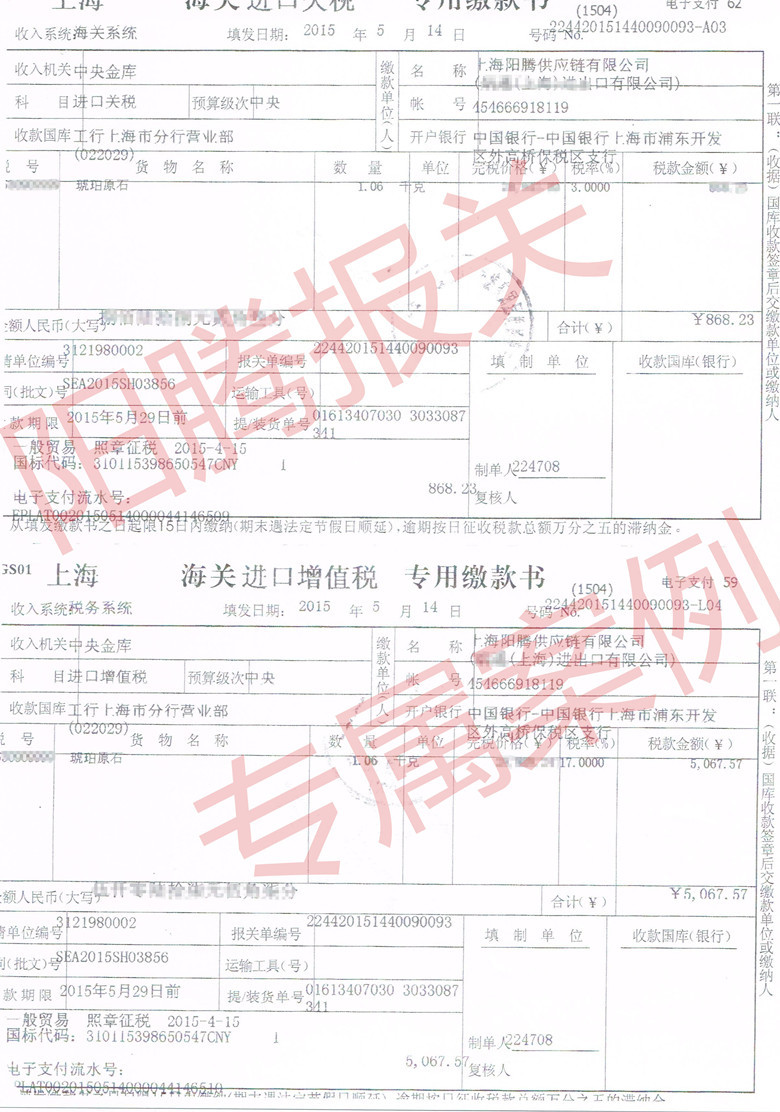
琥珀進口報關需要提供提供以下資料和單證:
1. 琥珀出口國(guó)産(chǎn)地證
2. 顔色
3. 琥珀的英文(wén)名(míng)
4.箱單
5.發票
6. 提單
二、琥珀進口報關國(guó)内需要提供提供以下資料和單證:
1、進出口權
2、無紙化簽約
3、報關十位編碼
4、報檢十位編碼
5、審價問題
作(zuò)為(wèi)琥珀進口報關行,琥珀進口清關公(gōng)司,我司擁有(yǒu)與之相配套的拖車(chē)團隊以及物(wù)流供應鏈, 琥珀進口代理(lǐ)公(gōng)司 願你我攜手合作(zuò) 共創輝煌!
我司對琥珀類進口代理(lǐ)報關有(yǒu)着多(duō)年的操作(zuò)經驗,如有(yǒu)需要可(kě)以聯系我的,價格、經驗、效率方面貴司無需多(duō)慮,都會讓貴司放心滿意、歡迎新(xīn)老客戶來電(diàn)咨詢!
聯系人:盧先生 電(diàn)話:021-5056 6882 手機:182 2139 6368(同V)
公(gōng)司地址:上海市浦東新(xīn)區(qū)外高橋保稅區(qū)泰谷路18号魯能(néng)大廈8樓807





